Die Technologie
ColiMinder™ Technologie und wie sie funktioniert.
Die mikrobiologische Kontamination …
der wichtigste Parameter der Wasserqualität, wird nach wie vor manuell in einem ein- bis dreitägigen Laborverfahren ermittelt, das sich nicht für Automatisierung, Online-Überwachung und Prozesskontrolle eignet. Die ColiMinder-Technologie basiert auf der direkten Messung der spezifischen metabolischen (enzymatischen) Aktivität der in der Probe vorhandenen Zielorganismen.
Die Technologie ist äußerst robust, direkt mit lebenden Organismen verknüpft und für alle Anwendungen geeignet. Die enzymatische Aktivität ist wissenschaftlich genau definiert
Direkte Messung der spezifischen Enzymaktivität in der Probe
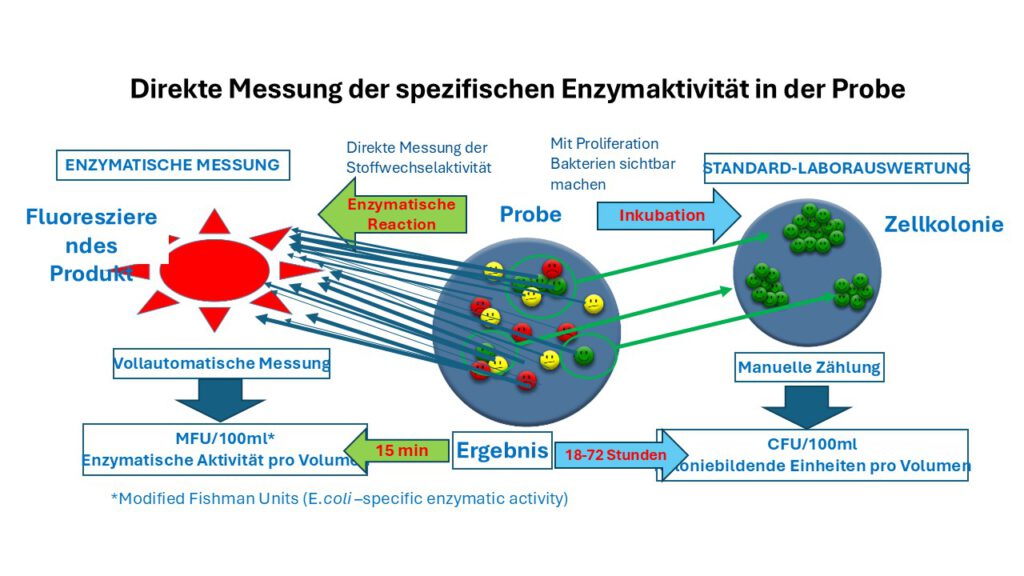
Enzymatische Bewertung
Der enzymatische Ansatz misst direkt die spezifische enzymatische Aktivität in der Probe. Die gemessene enzymatische Aktivität pro Probenvolumen dient als Maß für die Kontamination.
Der enzymatische Messansatz ist der einzige schnelle Messansatz, der eine technologieunabhängige Bestimmung von Kontaminationsgrenzwerten und eine messtechnikunabhängige Kalibrierung von Geräten ermöglicht.
Beide Voraussetzungen sind Voraussetzung für eine zukünftige Standardisierung. Der enzymatische Ansatz ist nicht auf Wasser beschränkt: Auch andere Flüssigkeiten, Oberflächenkontaminationen sowie Luft/Gase lassen sich damit messen.
Standard-Laborauswertungtabilität
Schnelle mikrobiologische Messverfahren
Es gibt zwei mögliche grundlegende Verfahren für die schnelle Messung mikrobiologischer Kontamination.
√ Untersuchung der einzelnen Zielorganismen
√ Messung des von der Gesamtpopulation der Zielorganismen erzeugten Signals
Traditionelle Methoden
Kulturbasierte Labormethoden kombinieren beide Ansätze, indem sie Individuen kultivieren, um eine hohe Anzahl (eine Verstärkung des Signals) zu erhalten, die mit bloßem Auge erkennbar ist.
Aufgrund des Zeitaufwands für die Kultivierung sind kulturbasierte Verfahren für die schnelle mikrobiologische Messung nicht geeignet.
Lebensfähigkeit
Bei mikrobiologischen Messungen ist es sehr wichtig, dass die Technologie zwischen lebenden und toten Organismen unterscheiden kann. Dies ist notwendig, um die Auswirkungen von Desinfektion oder anderen Behandlungsschritten zu messen.
Die Messung der Lebensfähigkeit erfordert Zeit und Reagenzien. Dies kann durch die Beobachtung einer biochemischen Reaktion (mithilfe eines Reagenzes) erfolgen, die nur in lebenden Organismen stattfindet.
Eine zweite theoretische Möglichkeit wäre die Beobachtung von Bewegungen von Organismen, die deren Lebensfähigkeit eindeutig belegen. Der Nachteil dieses Ansatzes besteht darin, dass Bewegungslosigkeit nicht unbedingt auf einen toten Organismus hindeutet.
Fazit: Die Messung der Lebensfähigkeit erfordert Zeit und Reagenzien.
Der enzymatische Ansatz
Der enzymatische Ansatz bewertet den Kontaminationsgrad durch Messung eines Signals aller Zielorganismen im Probenvolumen. Dieser Ansatz erfordert keine Probenvorbehandlung und weniger anspruchsvolle Technologie und ist daher robuster als Ansätze zur Bewertung einzelner Organismen.
Es gibt kein grundlegenderes Maß für die Lebensfähigkeit als die Stoffwechselaktivität.
Es gibt Enzyme, die spezifisch für bestimmte Organismen oder Organismengruppen sind. Dies bietet die Möglichkeit, die Stoffwechselaktivität der jeweiligen Zielorganismen spezifisch zu messen.
Indikatorbakterien
Durch den Vergleich verschiedener Messmethoden ist es wichtig, das Prinzip von Indikatorbakterien zu verstehen. E. coli, Enterokokken und die Gesamtaktivität (ALP) werden als Indikatoren für fäkale und mikrobiologische Kontamination verwendet. Je höher die Kontamination, desto höher das Risiko für Krankheitserreger und alle Arten von infektiösen Keimen, die sich über den Stoffwechsel verbreiten. Deshalb wird Wasser grundsätzlich auf E. coli und andere Bakterien getestet.
Die Frage, die durch die Untersuchung auf Indikatorbakterien beantwortet werden soll, lautet:
Wie hoch ist die fäkale Kontamination einer Probe? – Dies gibt Aufschluss über das Risiko.
Die klassische Methode zur Bestimmung des Kontaminationsgrades nutzt das Wachstum von Bakterien (E. coli, Enterokokken oder HPC) und die Anzahl der gebildeten Kolonien. Der ColiMinder® nutzt die Stoffwechselaktivität der in der Probe vorhandenen Zielorganismen (spezifische enzymatische Aktivität) als Maß für die Anzahl der lebenden Zielorganismen pro Probenvolumen und bestimmt so den Kontaminationsgrad und das Risiko.
Ein wichtiger Punkt ist hier zu erwähnen:
Die enzymatische Aktivität, beispielsweise die E. coli-spezifische ß-Glucuronidase-Aktivität, ist wissenschaftlich genau definiert.
Eine genaue wissenschaftliche Definition der ß-Glucuronidase erfolgt in modifizierten Fishman-Einheiten:
GUS / E. coli-spezifische enzymatische Aktivität
MFU (modifizierte Fishman-Einheit): Eine MFU setzt bei einem pH-Wert von 6,8 und 37 °C pro Stunde 1,0 μg Phenolphthalein aus Phenolphthalein-Glucuronid frei.
GLU / Enterococcus-spezifische enzymatische Aktivität:
Beta-D-Glucosidase (EC 3.2.1.21, CAS 9001-22-3) wird in „GU (Glucosidase-Einheiten)“ gemessen. Einheitendefinition: Eine GU (Glucosidase-Einheit) setzt 1,0 µmol p-Nitrophenol (pNP) aus p-Nitrophenyl-β-D-glucopyranosid (10 mM) pro Minute in 50 mM Natriummaleatpuffer, pH 6,5 bei 40°C frei (5).
Der ColiMinder® von VWM ist kalibriert und liefert ein Ergebnis der E. coli-Kontamination in modifizierten Fishman-Einheiten pro Volumen.
Diese Einheiten stellen die E. coli-spezifische enzymatische Aktivität pro Probenvolumen als direktes Maß für die Anzahl der lebenden Organismen pro Probenvolumen dar. Da der Messparameter der enzymatischen Aktivität wissenschaftlich exakt definiert ist, bildet er die Grundlage für die Festlegung entsprechender Grenzwerte für die tolerierbare Kontamination, ausgedrückt in enzymatischer Aktivität, für alle Arten von Anwendungen.
ALP / Gesamtenzymatische Aktivität:
Alkalische Phosphatase (EC 3.1.3.1, CAS 9001-78-9) wird in „U (Units)“ gemessen. Einheitendefinition: Eine Unit (U) hydrolysiert 1,0 µmol para-Nitrophenylphosphat (pNPP) pro Minute in Glycinpuffer bei pH 10,4 und 37 °C.